Расшифрована структура одной из ключевых молекул иммунной системы
Опубликовано lana в 29 декабря, 2010 - 05:59
Группа ученых из Школы медицины Университета
Пенсильвании (University of Pennsylvania) и Утрехтского университета
(Utrecht University) расшифровала структуру ключевого звена одного из
наиболее древних с эволюционной точки зрения компонентов иммунитета. Эта
система, называемая комплементом, включает в себя сеть
белков, «дополняющую» работу антител при уничтожении «иноземных
захватчиков». Она служит механизмом быстрой защиты у большинства видов
живых организмов – от примитивных губок до человека.
В исследовании, опубликованном в журнале Science, группы доктора философии Джона Лэмбриса (John Lambris) из Университета Пенсильвании и Пита Гроса
(Piet Gros) из Утрехта установили атомную структуру двух ключевых
короткоживущих ферментных комплексов системы комплемента человека.
Белки комплемента помечают как бактериальные, так и умирающие клетки
организма-хозяина для удаления клеточными «службами очистки» и
причастны, по крайней мере, к 30 заболеваниям, включая инсульт, инфаркт
миокарда и возрастную макулярную дегенерацию. Результаты работы
обеспечивают молекулярную основу для создания новых лекарственных
препаратов.
«Теперь мы сможем разработать специфические ингибиторы комплемента,
чтобы воздействовать на этот комплекс и таким образом подавлять
активацию его каскада, так как теперь мы знаем, какие части белков важны
для его активации», – комментирует результаты работы Лэмбрис.
В отличие от адаптивного иммунитета, в котором клетки-посредники,
такие как В- и Т-лимфоциты, учатся выбирать в качестве мишеней
специфические антигены путем распознавания либо антител, либо клеточных
рецепторов, система комплемента является формой врожденного, или общего,
иммунитета. Процесс взаимодействия компонентов системы комплемента
разворачивается как сложная биохимическая сеть молекулярных и клеточных
коммуникативных событий, в результате чего достигается разрушение и
удаление патогенов и поврежденных клеток и, в конечном итоге,
рекрутирование клеток иммунной системы.
Два изученных Лэмбрисом ферментных комплекса, C3bB и C3bBD, управляют центральной стадией усиления ответа с помощью белков комплемента. На этой стадии белок комплемента С3 ферментативно расщепляется С3-конвертазой, образуя комплекс C3b, который связывается с поверхностью клетки-мишени. Затем C3b взаимодействует с фактором В, образуя комплекс C3bB. Этот комплекс, в свою очередь, связывает другой фермент, фактор D (образуя С3bBD), расщепляющий комплекс с образованием активного C3bBb. Основной мишенью активного C3bBb является сам белок С3, что приводит к быстрой амплификации каскада комплемента.
Чтобы получить структурные снимки C3bB и C3bBD, ученые сначала
создали мутантные белки, способные стабилизировать комплексы в их
активных формах. Для описания обоих комплексов на атомном уровне Лэмбрис
и Грос использовали рентгеновскую кристаллографию. Они установили, что
при взаимодействии с C3b фактор В изменяет свою форму, образуя «открытый
комплекс», который затем может связаться с фактором D. Фактор D, в свою
очередь, также изменяет свою форму, однако в меньшей степени, что не
умаляет важности этого изменения: свободный белок неактивен, потому что
одна из белковых петель блокирует активный сайт фермента. При связывании
с C3bB эта петля изменяет положение, активируя, таким образом, фактор D
и делая его способным расщепить C3bB в комплекс C3bBb.
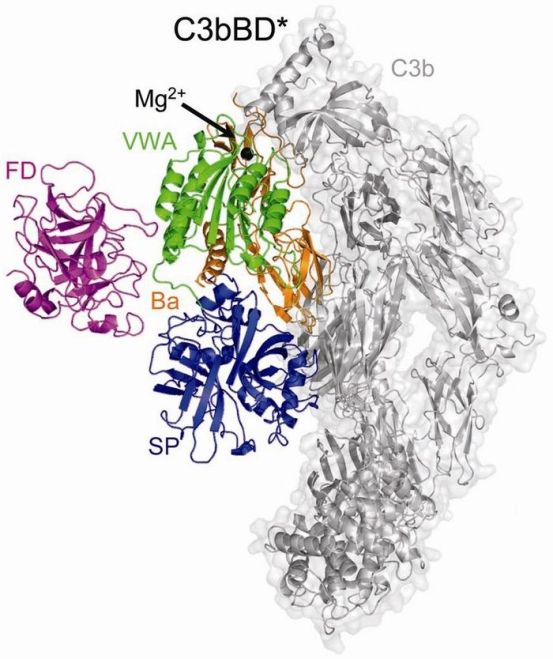 Молекулярная структура проконвертазы комплемента в комплексе с фактором D. Механизм «двойного Молекулярная структура проконвертазы комплемента в комплексе с фактором D. Механизм «двойного
предохранителя», включающий в себя тщательно организованное и многоуровневое взаимодействие
трех белков (C3b, фактора B, фактора D), гарантирует, что разрушительное действие комплемента
ограничится клеткой-мишенью, такой как патогенный микроорганизм.
(Credit: Federico Forneris & Piet Gros/Utrecht University, The Netherlands)
Эти открытия, говорит Лэмбрис, дают молекулярное объяснение
нескольким особенностям обеспечения безопасности системы комплемента.
Прежде всего, они объясняют, почему фактор D не активен сам по себе, но
становится активным после взаимодействия с C3bB. Они показывают и
механизм «двойного предохранителя», используемого системой для
предотвращения активации комплемента в отсутствии мишени.
Кроме того, проливая свет на в высшей степени изящный механизм
согласованной активации и внутренней регуляции, эта работа дает
детальное представление об одной из самых важных терапевтических мишеней
в системе комплемента, что может способствовать рациональной разработке
лекарственных средств. Она предоставляет данные, которые могут быть
использованы при создании новых препаратов – ингибиторов фактора D – для лечения комплемент-зависимых заболеваний.
Аннотация к статье: Structures of C3b in Complex with Factors B and D Give Insight into Complement Convertase Formation
Пожалуйста, оцените статью:
- Источник(и):
LifeSciencesToday http://www.uphs.upenn.edu/…-structures/
http://www.nanonewsnet.ru/news/2010/rasshifrovana-struktura-odnoi-iz-klyuchevykh-molekul-immunnoi-sistemy
|









