Переворачивая титановые листы
Ключевые слова:
литиевая батарея, оксид титана
Опубликовал(а):
Шуваев Сергей Викторович
Диоксид
титана - один из наиболее перспективных кандидатов для использования в
качестве материала анода в литий-ионных батареях. Его выбор весьма не
случаен - при интеркаляции ионов лития объем элементарной ячейки
изменяется менее, чем на процент, что позволяет многократно проводить
процесс зарядки/разрядки без разрушения анода. Кроме того, TiO2
инертен по отношению к большинству используемых электролитов. Тем не
менее, чтобы сделать применение диоксида титана возможным, исследователю
необходимо в разы увеличить удельную поверхность по сравнению с
объемным материалом. Поэтому к настоящему времени предложено множество
наноструктур TiO2 различной геометрии, которые более или
менее успешно примерялись на роль анода в литий-ионных батареях.
Поддерживая этот тренд, коллектив ученых из Сингапура предложил
оригинальный (и что немаловажно "экологичный") метод синтеза нанолистов
оксида титана, стабилизированных аморфным углеродом (CTNS).
На рисунке 1 вкратце
изображен предложенный авторами статьи метод синтеза углеродных
нанолистов, стабилизированных ионной жидкостью ([(CH3)2N+(H)-C2H4OH][CH3COO−]), которые затем подвергаются карбонизации при 3500С. Крайне важно, что ключевую роль в образовании конечной структуры играют ионы лития, которые ингибируют рост кристалла TiO2
вдоль направления [010], поскольку при их отсутствии вместо слоистой
образуется сплошная структура. Анализируя результаты ПЭМ (просвечивающей
электронной микроскопии), авторы статьи отмечают, что толщина одного
нанолиста равна 0.4 нм, что соответствуют периоду элементарной ячейки
анатаза вдоль направления [010] (рис.2).
Чтобы подтвердить
механизм, предложенный на рисунке 1, исследователи сравнили
рентгенограммы, снятые при разных температурах (рис.3). При низких
температурах отчетливо заметен интенсивный пик (2θ = 8.48°),
подтверждающий образование многослойной структуры (LTNS),
стабилизированной молекулами ионной жидкости. По мере роста температуры
выше 2500С интенсивность пика снижается, что соответствует карбонизации ионной жидкости, пока полностью не исчезает при 3500С,
что подтверждает образование неупорядоченной структуры. В то же время, с
ростом температуры растет интенсивность пиков, соответствующих фазе
анатаза, до тех пор, пока она не станет единственной при температуре 4000С.
Для исследования
электрохимических свойств полученного материала авторы статьи собрали
двухэлектродную ячейку, в которой литий выступает и как противоэлектрод,
и как электрод сравнения. В отличие от ячеек, в которых используются
аноды из уже известных материалов на основе анатаза, профили
зарядки/разрядки демонстрируют неизменный градиент при различных токах
разрядки в отличие от привычного плато. Ученые объясняют эту аномалию
тем, что диффузия ионов лития протекает в основном на поверхности
слоистых структур, что сродни зарядке конденсатора, поэтому плато,
соответствующее внедрению ионов лития внутрь фазы анатаза (при
интеркаляции/деинтеркаляции лития), не наблюдается.
Источник: Advanced Materials

Рисунок 1.
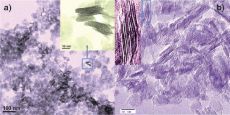
Рисунок 2. ПЭМ-микрофотографии LTNS (a) и CTNS (b).
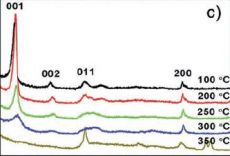
Рисунок 3. РФА-анализ образца, отожженного при различных температурах.
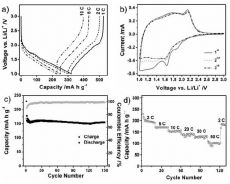
Рисунок 4. а) Первый цикл зарядки/разрядки при различных
токах разрядки. b) Циклическая вольтамперограмма при скорости съемки
1мВ/с. c) Зависимость емкости ячейки от количества циклов
зарядки/разрядки при скорости разрядки 10 С и соответствующая
фарадеевская эффективность. d) Зависимость емкости ячейки от количества
циклов зарядки/разрядки при различных скоростях разрядки.
http://www.nanometer.ru/2011/02/01/12965885461364_254116.html
|









